ادجوانت هاي پلیمری (ذرات پلیمری)
نانوذرات به عنوان ذراتی با قطر در محدوده زیر میکرومتر تعریف میشوند که خواصی را از خود نشان میدهند که در یک ماده بزرگتر یافت نمیشود. این تعریف کلاسیک خیلی خاص نیست، اما با حوزه های مختلف علم سازگار است. مفهوم اصلی استفاده از نانوذرات برای تحویل دارو در اواخر دهه 1950 ظاهر شد[[i]]، به دنبال آن مقالات دیگری که به عفونت هایی مانند کزاز، دیفتری و سایر بیماری هایی که نیاز به دوزهای متعدد واکسن دارند، پرداختند [[ii]]. واکسن های توصیف شده در مقالات بر اساس فرمول های میسلی بودند. از آن زمان و به دلیل پیشرفت در فناوری دارویی و ایمونولوژی، انواع مختلفی از ذرات به عنوان پلتفرم های تحویل، توسعه یافته اند[[iii],[iv],[v]] . تنوع ساختارها از میکرو و نانوذرات، نانوژل ها، میکرو و نانوکپسول ها تا دندریمرها، وزیکول ها و میسل ها، همانطور که در شکل1-1 نشان داده شده است، متغیر است.
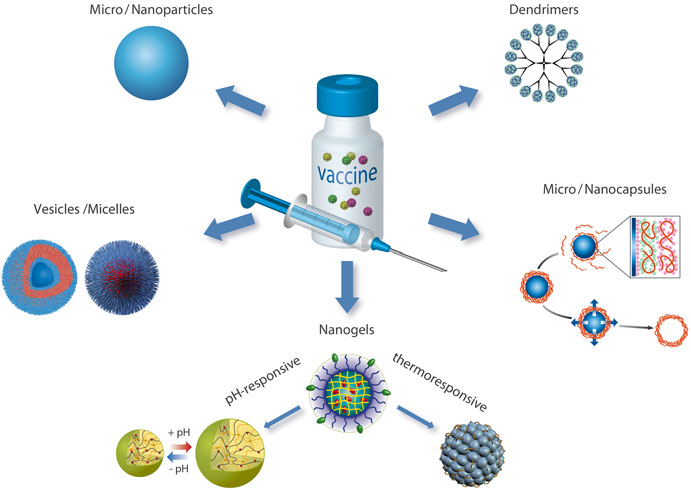
شکل. سیستم های تحویل آنتی ژن موجود بر اساس ذرات پلیمری
در چند سال گذشته، تعداد مقالات منتشر شده در مورد واکسن های زیرواحد ( آنتی ژن، پروتئین، پپتید،DNA و غیره) و به همین ترتیب، بررسی های مربوط به پلت فرم های تحویل خاص افزایش یافته است. با این وجود سیستم های تحویل واکسن با استفاده از نانوذرات هنوز در مراحل ابتدایی هستند و نیاز به غلبه بر برخی چالشها (مانند پیشگیری از عوارض جانبی مربوط به سمیت، راندمان بالای محصور کردن مواد زیست فعال، سهولت تجویز و معرفی یک پاسخ ایمنی خاص آنتیژن) دارد[[vi]] .
– نانو و میکرو ذرات پلیمری
در حال حاضر، رایج ترین پلیمرهای مورد استفاده در آزادسازی کنترل شده دارو که زیست سازگار و زیست تخریب پذیر بوده و همچنین برای کاربردهای زیست پزشکی مورد تایید FDA می باشد عبارتند از: پلیلاکتیک-کو-گلیکولیک اسید (PLGA)، پلی لاکتیک اسید (PLA)، پلی گلوتامیک اسید (PGA)، پلی کاپرولاکتون ، N-(2-). کوپلیمرهای هیدروکسی پروپیل) – متاسیلات (HPMA) و اسیدهای پلی آمیدو[[vii]] .
ذرات PLGA که در تحویل واکسن های زیرواحدی استفاده می شوند، می توانند با روش های مختلفی از جمله خشک کردن پاششی یا اسپری، جداسازی فاز، تبخیر با حلال و استخراج با حلال تهیه شوند [[viii]].
استفاده از ذرات PLGA در واکسیناسیون علیه بیماری های مختلف از جمله کزاز، مالاریا، HIVو هپاتیت B مورد مطالعه قرار گرفته است. با این حال، بر خلاف سیستم تحویل واکسن، سیستم های مختلف تحویل دارو بر اساس ذرات PLGA، PLA و PGA توسعه یافته تراند و از نظر بالینی تایید و تجاری شده اند که از آن جمله می توان به استفاده در درمان سرطان، آکرومگالی، بیماری پریودنتال و اسکیزوفرنی اشاره کرد[[ix]].
علاوه بر PLGA، مواد دیگری مانند کیتوسان و مشتقات آن در ایمونوتراپی استفاده شده اند. به طور کلی، کیتوسان به دلیل غیرسمی بودن، تجزیه پذیری زیستی و فراوانی در طبیعت، برای دهه ها در کاربردهای زیست پزشکی مورد استفاده قرار گرفته است [[x]]. آلونسو و همکارانش جزو اولین کسانی بودند که سیستم های مختلف کیتوسان را برای تحویل پروتئین با تمرکز بر تجویز بینی و چشمی مطالعه کردند[[xi]]. اخیراً، این گروه امکان تحویل داخل بینی آنتی ژن های هپاتیت B را با استفاده از نانوحامل های مختلف مبتنی بر کیتوسان نشان داده است.[[xii]]
پلت فرم جالب دیگری که بر اساس دکستران استاله شده (Ac-DEX) است، توسط گروه Fréchet برای تحویل RNA مداخله گر کوچک (siRNA) ارائه شده است [[xiii]]. مطالعه دیگری در مورد ایمنی محافظتی با استفاده از سیستم تحویل Ac-DEX نشان داده است که بسته به درجه و نوع اصلاح استال، مسیرهای ارائه آنتی ژن نیز می تواند تنظیم شود.[[xiv]]
-نانوژل ها
نانوذرات هیدروژل یا نانوژل ها، ذرات پلیمری متقاطعی[2] هستند که از پلیمرهای آمفیفیلک[3] یا پلی یونی تشکیل شده اند. مواد مورد استفاده عموماً زیست سازگار و دارای خواص مکانیکی متوسطی هستند. اندازه قابل تنظیم آنها، سطح بزرگ موجود برای بیوکونژوگه، قابلیت تزریق آنها و امکان دستیابی به مدت طولانی انتشار، آنها را به پلتفرم های تحویلی جالب تبدیل می کند. ترکیبات نانو ژل ساخته شده از پلیمرهای طبیعی (به عنوان مثال، آلژینات) و نانوذرات هیدروژل مصنوعی مبتنی بر پلی وینیل الکل (PVA)، پلی اتیلن اکسید (PEO)، پلی اتیلن ایمین (PEI)، پلی وینیل پیرولیدون (PVP)، و پلی -Nایزوپروپیل آکریل آمید (PNIPAm) به طور گسترده در کاربردهای دارورسانی مورد بررسی قرار گرفته اند.[[xv]] بطور کلی در نانو ژل ها فضای داخلی شبکهها متورم شده و فضایی را برای ترکیب مولکولهای فعال زیستی (داروهای مولکولی کوچک، پروتئینها، DNA و غیره) فراهم میکند که ترکیبات فعال میتوانند تحت شرایط خاص از ماتریکس پلیمری آزاد شوند. صرف نظر از نوع پلیمر، آزادسازی ترکیب فعال از نانوذرات هیدروژل از یک مکانیسم پیچیده پیروی می کند و به سه عامل اصلی بستگی دارد: (1) انتشار دارو، (2) تورم ماتریکس هیدروژل (درجه اتصال عرضی) و (3) وابستگی شیمیایی بین دارو و ماتریکس[[xvi]].
اولین نانوذرات هیدروژل مورد استفاده برای اهداف واکسیناسیون توسط کروتر و همکاران تهیه شد که ذرات پلی (متیل متاکریلات) (PMMA) را با پلیمریزاسیون مونومرهای متیل متاکریلات در حضور ویروس آنفولانزا یا با افزودن ویروس به PMMA از پیش آماده شده سنتز کردند. پاسخ آنتی بادی در موش ها و خوکچه هندی اندازه گیری شد، مورفولوژی ذرات با استفاده از میکروسکوپ الکترونی و واکنش ایمنی ذرات با استفاده از هماگلوتیناسیون و سنجش آنتی بادی مورد بررسی قرار گرفت .نتایج نشان داد که سیستم پلیمریزه همزمان مونومرهای متیل آکریلات و ویروس ها به طور قابل توجهی موثرتر از افزودن ساده ویروس ها به پلیمر پیش پلیمریزه شده بود[[xvii]]. اخیراً، Fréchet و همکارانش ذرات هیدروژل پلی آکریل آمید را با قسمت های حساس به اسید پیوند زدند و آنها را با DNA تحریک کننده سیستم ایمنی استفاده کردند. آنها توجه ویژه ای به تأثیر اندازه ذرات بر فعال شدن سلول های T نشان دادند. در این پژوهش برخلاف گزارشهای قبلی، نویسندگان پیشنهاد کردند که تفاوت معنیداری در میزان فعالسازی سلول T بین اندازه ذرات میکرو و نانومتری حامل آنتی ژن های پروتئینی وجود ندارد[[xviii]]. علاوه بر تحقیقات بر روی ذرات هیدروژل پلی آکریل آمید، گروه Sjoholm در طول دهه 1980 پلی اکریل دکستران و نشاسته پلی اکریل را به منظور بهبود زیست تخریب پذیری این نانوذرات به طور گسترده مورد مطالعه قرار دادند. سینتیک آنزیم، مشخصات رهاسازی، محلی سازی سطح و پایداری حرارتی مورد بررسی قرار گرفت .علاوه بر این، تخریب ریزذرات در سرم و اندامکهای هدف، لیزوزومها، در شرایط آزمایشگاهی مورد آزمایش قرار گرفت. این امر با کپسولهسازی آنتیژنهای HSA و آلبومین سرم موش (MSA) و بررسی توانایی آنها در تحریک پاسخ ایمنی در موشها دنبال شد. در مورد MSA محبوس شده در ذرات، هیچ پاسخ قابل تشخیصی پس از تجویز به دست نیامد، در حالی که HSA محصور شده یک پاسخ ایمنی وابسته به دوز را القا می کند[[xix]] . در مطالعه دیگری سیستم های تحویل واکسن مبتنی بر پلی ساکارید به دست آمده از کیتوسان و سولفات دکستران (DEXS) بارگیری شده با پروتئین کپسید HIV-1 مورد مطالعه قرار گرفت و یک پاسخ ایمنی خاص در موش هایی با تولید آنتی بادی بالا مشاهده شد[[xx]].
– میکرو و نانو کپسول ها
میکرو و نانوکپسول ها ساختارهای کروی شکل توخالی یا پر شده ای هستند که می توانند برای محصور کردن مواد دارویی استفاده شوند. مجموعه های پلی پپتیدی مانند نانوکپسول های زیستی (BNCs)[4] از آنتی ژن سطحی ویروس هپاتیت B (HBsAg)[5] یا کپسول های پلی-γ-گلوتامیک اسید نیز تحت این تعریف قرار می گیرند. اگرچه این سازه های طبیعی جذاب هستند، اما توضیح بیشتر آنها خارج از تمرکز این فصل است. اختراع تکنیک ریزپوشانی لایه به لایه (LbL) در اواخر دهه 1990 توسط Decher، دانشمندان را برای استفاده از این روش در تحویل واکسن الهام بخشید[[xxi]]. جذب تکراری و متناوب پلی الکترولیتهای با بار مخالف، یعنی پلیکاتیونها و پلیآنیونها، برای ایجاد چندلایه روی بسترهای کلوئیدی مورد استفاده قرار گرفت و در نتیجه میکروکپسولهای پلیالکترولیت به عنوان سیستمهای حامل واکسنها را تشکیل داد. انواع مختلف این خانواده از ادجوانت ها عبارتند از جفت های پلی آنیون/پلی کاتیون، پلی استایرن سولفونات / پلی آلی آمین هیدروکلراید (PSS/PAH)، سولفات دکستران/پلی آرژنین (DEXS/pARG) ،DNA / پلی لیزین یا پلی گلوتامیک اسید (DNA/PLL) یا PGA، و پلی (متااکریلیک اسید) / پلی (وینیل پیرولیدون) (PMA/PVPON) . این نمونه ها شامل پلی الکترولیت های تجزیه ناپذیر مانند (PSS/PAH) و زیست تخریب پذیر مانند (DEXS/pARG) هستند که می توانند بر اساس نیازهای خاص انتخاب شوند. مکانیسم های آزادسازی متفاوتی بر اساس این مواد گزارش شده است.کپسول های پلی الکترولیت با هسته های میکروژل HEMA بار خود را از طریق تجزیه زیستی ژل آزاد می کنند که باعث پارگی پوسته چند لایه می شود.کپسول های زیست تخریب پذیر DEXS/pARG به طور موثری توسط DC ها از طریق مسیر ماکروپینوسیتوز جذب می شوند و پس از تخریب درون سلولی، بار خود را آزاد می کنند. کپسول های پلی الکترولیت PMA SH / PVPON، که از نظر اندازه و بارگذاری واکسن پپتیدی قابل کنترل هستند، به گونه ای طراحی شده اند که با پارگی پیوندهای دی سولفید پس از قرار گرفتن در معرض شرایط کاهشی، واکسن پپتیدی را متلاشی و آزاد کنند. نشان داده شد که آنها در APCها درونی ، آزاد شدند و محموله خود را در یک زمینه MHC کلاس I برای برانگیختن پاسخ ایمنی ارائه کرده اند. یک رویکرد نسبتا جدید واکسیناسیون DNA است، که در آن یک پلاسمید کد کننده پروتئینی از یک پاتوژن به سلول های انسانی وارد می شود. هنگامی که پلاسمید در داخل سلول قرار می گیرد، پروتئین پاتوژن تولید می شود، به عنوان خارجی شناخته می شود و در سطح سلول میزبان نمایش داده می شود که سیستم ایمنی را فعال می کند. اشکالات این رویکرد هدف گیری ضعیف APCها و ایمنی زایی کم است.
میکروکپسولها با استفاده از این رویکرد آزمایش شدهاند، جایی که تحویل و پردازش کارآمد DNA، یعنی تولید مقدار کافی آنتی ژن کدگذاری شده، از اهمیت کلیدی برخوردار است. در این سیستم ها، DNA به عنوان پلی آنیون طبیعی در تکنیک LbL استفاده می شود که منجر به کاهش تخریب آنزیمی پلی نوکلئوتیدها می شود. میکروکپسولهای فرسایشپذیر با بارگذاری DNA به خوبی کنترلشده، که از طریق تکنیک LbL انجام شد، در انتقال محموله به رده سلولی ماکروفاژ موش مفید بودند و منجر به آزاد شدن تدریجی DNA پلاسمید در شرایط فیزیولوژیکی شدند.
–دندریمرها
کلمه “دندریمر” از کلمات یونانی dendron، “درخت” و” meros قسمت” گرفته شده است. هسته در مرکز سازه دارای حداقل یک نقطه انشعاب و سه گروه لنگر است. بنابراین، در نسل دوم، حداقل سه مونومر را می توان ترکیب کرد. با هر نسل اضافی، جرم مولکولی و تعداد گروه های سطحی دو برابر افزایش می یابد. سنتز گام به گام اجازه می دهد تا ساختارهای بسیار متقارن با وزن مولکولی کاملاً تعریف شده تولید شود. شاخه های پلیمر به گونه ای قرار می گیرند که دندریمر دارای ساختار کروی باشند. بر خلاف پلیمرهای خطی یا تصادفی شاخه دار، ساختار مکانی دارند. پلیمرهای دندریمری اولین بار توسط Vögtle و همکاران گزارش شده اند[[xxii]]. در سالهای گذشته، سنتز دندریمرها برای تولید مولکولهای بزرگتر تکامل یافت. درجه بالای انشعاب منجر به تراکم بالای عملکردها در سطح و در نتیجه ساختار چند ظرفیتی می شود. با تعداد تولید دندریمرهای بالاتر، ویژگی های دندریمر تحت سلطه گروه های انتهایی و اندازه آن قرار می گیرد، در حالی که از هسته نیز محافظت می شود. علاوه بر این، درجه بالایی از عملکردها در گروه های انتهایی، تغییرات مختلفی را امکان پذیر می کند، که دندریمرها را به عنوان سیستم های تحویل واکسن جذاب می کند. در سال 1988، تام سیستم به اصطلاح پپتید آنتی ژنی چندگانه (MAP)[6] را توسعه داد که اولین سیستم دندریمر مانند تحریک کننده ایمنی بود. Posnett بخش دندریتی MAP از لیزین ساخته شده است. سیستمهای MAP نامتقارن هستند و شکل گوهای[7] دارند، زیرا آلفا و بتا آمینهای هسته لیزین بهعنوان یک نقطه لنگر برای نسل بعدی عمل میکنند و گروه کربوکسیلیک کورلیزین با اسیدهای آمینه یا لیپیدهای دیگر اصلاح میشود[[xxiii]]. غالباً از دندریمرهای لیزین نسل دوم یا سوم استفاده می شود که چهار یا هشت نقطه لنگر را برای آنتی ژن های با وزن مولکولی کم ، به عنوان مثال پپتیدهای کوتاه، ارائه می دهند[[xxiv]]. طراحی ساده و سهولت سنتز به موفقیت این سیستم کمک کرده [[xxv]]و دندریمرهای PAM کاندیدهای امیدوارکننده ای برای تحویل واکسن علیه ایدز [[xxvi]] ، ویروس تب خوکی [[xxvii]] و مالاریا[[xxviii]] می باشند. علاوه بر این، از دندریمرها برای تحویل واکسن های مبتنی بر DNA استفاده شده است. دفتریان و همکاران پپتیدهای هدفمند MHC کلاس II کونژوگه را بر روی نسل پنج PAMAMبار گزاری کرده اند و راندمان ترانسفکشن بالا، هدف گیری اختصاصی به APCها و افزایش ایمنی زایی را گزارش داده اند[[xxix]].
–پلیمرزوم ها و میسل ها[8]
کوپلیمرهای بلوکی با خواص آمفی دوست را می توان با استفاده از مونومرهایی با قطبیت های مختلف (به عنوان مثال، آبگریز/آب دوست) سنتز کرد. گروههای دیشر و آیزنبرگ کشف کردند که کوپلیمرهای بلوک آمفیفیلیک در محلول آبی به ساختارهای وزیکولی (پلیمرزومها) خودآرایی میشوند [[xxx],[xxxi]]. پلیمرزم ها دارای یک حفره آبی هستند که توسط یک غشای آبگریز احاطه شده است. داروها یا آنتی ژن ها را می توان در هسته آبدوست یا درون آبگریز غشای پلیمرزومی بدون از بین بردن عملکرد آنها کپسوله کرد. برخلاف وزیکول ها، میسل ها کوچکتر هستند و دارای یک هسته آبگریز هستند که توسط یک تاج آبدوست احاطه شده است. با توجه به تقاضاهای پلت فرم تحویل واکسن، در جایی که محموله های آبدوست (آنتی ژن) و آبگریز (ادجوانت) لازم است به طور همزمان محصور شوند، مورفولوژی وزیکولی سودمند است[[xxxii]]. سیستم های پلیمرزومی قابل تحریک نیز می توانند برای رهاسازی کنترل شده ایجاد شوند. چنین سیستم هایی برای انتقال siRNA به سلول ها توسعه داده شدند. در این سیستم ها انتشار از طریق ادغام پیوندهای قابل تحریک با pH ، که به دلیل محیط اسیدی در لیزوزوم ها در داخل سلول ها شکافته شده و باعث ترکیدن پلیمرزوم ها می شوند، کنترل می شود[[xxxiii]].
استفاده از کوپلیمرهای دوبلوک کاتیونی امکان برهمکنش های الکترواستاتیکی با مولکول های DNA و RNA را فراهم می کند و بنابراین بازده بارگذاری بالاتری را در مقایسه با کپسوله سازی غیرفعال می دهد[[xxxiv]]. برخلاف لیپوزوم ها، پلیمرزوم ها ساختاری پایدار و از نظر شیمیایی قابل تنظیم تر برای محافظت از آنتی ژن یا DNA/RNA در برابر فرآیندهای تخریب ارائه می دهند[[xxxv]]. گروه کاتائوکا یکی از اولین گروه هایی بود که از میسل های کمپلکس پلی یون برای تحویل واکسن استفاده کرد. آنها از کوپلیمرهای بلوکی پلی اتیلن گلیکول- پلی ʟ- لیزین (PEG-PLL) برای تشکیل میسل استفاده کردند و از تعامل الکترواستاتیک برگشت پذیر بین DNA و پلیمر برای خودآرایی استفاده کردند. در این سیستم DNA در هسته میسل محصور شده توسط PEG به دام افتاد و در نتیجه DNA را از دناتوره شدن شیمیایی یا آنزیمی محافظت می شود. چنگ و همکاران با استفاده از پلیمرزومی مشابه نشان دادند که تعدادی از پروتئین های مختلف را می توان در وزیکول بارگذاری و سپس آزاد کرد. این یک پلت فرم قابلیت اجرای عمومی برای تحویل واکسن فراهم میکند و نیازی به تطبیق با آنتی ژن های خاص ندارد[[xxxvi]].
[1] Nanogels
[2] Cross-linked Polymeric Particles
[3] Amphiphilic
[4] bio-nanocapsules
[5] hepatitis B virus surface antigen
[6] multiple antigen peptide system
[7] wedge-like shape
[8] Polymersomes and Micelles